Fuerzas Intermoleculares

Interacción Dipolo-Dipolo
En un líquido, por ejemplo, las moléculas están muy cercanas entre sí, unidas por fuerzas intermoleculares, por ejemplo interacciones dipolo-dipolo. Cuanto mayor es la fuerza intermolecular que las une, mayor será el punto de ebullición del líquido, dado que se necesitará más energía para romper dichos enlaces.
Enlace Puente De Hidrógeno
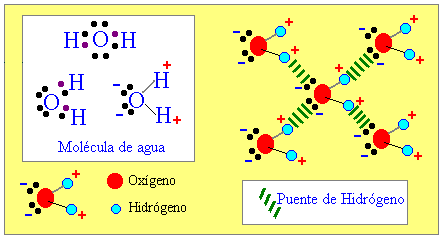
Las fuerzas intermoleculares se definen como el conjunto de fuerzas atractivas y repulsivas que se producen entre las moléculas como consecuencia de la polaridad que poseen las moléculas.
Cuando dos o más átomos se unen mediante un enlace químico forman una molécula, los electrones que conforman la nueva molécula recorren y se concentran en la zona del átomo con mayor electronegatividad, definimos la electronegatividad como la propiedad que tienen los átomos en atraer electrones. La concentración de los electrones en una zona definida de la molécula crea una carga negativa, mientras que la ausencia de los electrones crea una carga positiva.
Denominamos dipolos a las moléculas que disponen de zonas cargadas negativamente y positivamente debido a la electronegatividad y concentración de los electrones en las moléculas.

Interacción Dipolo-Dipolo
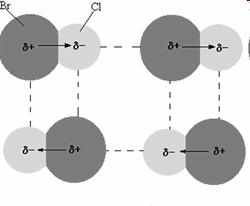
La interacción dipolo-dipolo es la observada entre un dipolo positivo de una molécula polar con el dipolo negativo de otra. En los enlaces covalentes polares, el átomo con mayor electronegatividad atrae los electrones hacia sí, formándose un dipolo negativo en torno al mismo. En el átomo con menor electronegatividad, el dipolo formado es de carga positiva, ya que cede parcialmente sus electrones.
La fuerza de este tipo de interacción dipolo-dipolo es bastante débil, de un promedio de 4 kJ por mol, en comparación con la energía de enlaces covalentes o iónicos.
Un ejemplo puede ser el de las moléculas de cloruro de bromo. Las interacciones dipolo-dipolo se representan con líneas punteadas.

Existen tres tipos de interacción dipolo-dipolo:
interacción dipolo permanente: Es el que ocurre entre dos moléculas cuyos enlaces son covalentes polares, es decir, que forman dipolos por diferencia de electronegatividad entre sus átomos.
interacción dipolo inducido: Se produce cuando en moléculas no polares, el dipolo es inducido, por ejemplo mediante un campo eléctrico.
También existen interacciones entre un dipolo permanente y un dipolo inducido. Los iones también son capaces de interaccionar con dipolos de moléculas, ya sean éstos permanentes o inducidos.
La interacción dipolo-dipolo también puede suceder entre dos partes de la misma molécula, si ésta es lo suficientemente grande.
Dipolos dispersos: Este último caso la unión se produce entre moléculas no polares pero que pueden polarizarse, y cuando esto último ocurren se atraen mutuamente creando la unión molecular.
La unión que se crea en este tipo de dipolos tiene una intensidad muy débil y una vida muy corta
Las energías de unión generadas por las fuerzas intermoleculares son más reducidas que las energías generadas en los enlaces químicos, pero existen en mayor número que los otros, por lo que a nivel global implican un papel muy importante.
Enlace Puente De Hidrógeno
El enlace puente de hidrógeno es una atracción que existe entre un átomo de hidrógeno (carga positiva) con un átomo de O , N o X (halógeno) que posee un par de electrones libres (carga negativa).
Por ejemplo el agua, es una de las substancias que presenta este tipo de enlaces entre sus moléculas. Una molécula de agua se forma entre un átomo de Oxigeno con seis electrones de valencia (sólo comparte dos y le quedan dos pares de electrones libres) y dos hidrógenos con un electrón de valencia cada uno (ambos le ceden su único electrón al oxígeno para que complete el octeto).
La molécula de agua es una molécula polar, por lo que presenta cuatro cargas parciales, de esta manera la fracción positiva (un hidrógeno) genera una atracción con la fracción negativa de otra molécula (el par de electrones libres del oxígeno de otra molécula de agua). Teóricamente una molécula de agua tiene la capacidad de formar 4 puentes de Hidrógeno.
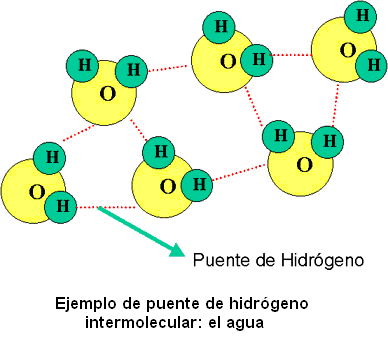
Si se compara al H2O , con el H2S deberían de ser substancias muy parecidas ya que el oxígeno y el azufre pertenecen al mismo grupo (VIA), tienen propiedades parecidas, la diferencia es que el oxígeno es más electronegativo.
Los puentes de hidrógeno generalmente se producen por la atracción electrostática entre átomos electronegativos (como el O o el N) y un átomo de hidrógeno está unido covalentemente a un segundo átomo electronegativo (como el O o el N). Por ejemplo:
| -O-H | |
| -N-H | |
| -O-H |

En este vídeo vemos un buen repaso sobre todo lo visto:
Bibliografia